激光原子力显微镜观察肌动蛋白体外自组织纤维结构多态性的初步研究
激光生物学报 第13 卷第4 期 2004 年8 月
张军1 ,2 ,王远亮1 ,CHEN Xin-yong3 ,何创龙1 ,程超1
(1. 重庆大学教育部生物力学及组织工程重点实验室,中国重庆400044 ;2. 重庆医科大学生物学教研室,中国重庆 400016 ;3. Laboratory of Biophysics and Surface Analysis , University of Nottingham , Nottingham NG7 2RD , United Kingdom)
摘要
利用原子力显微镜(atomic force microscope , AFM) 技术,研究了肌动蛋白体外通过自组织过程形成的纤维结构及其多态性。肌动蛋白在体外通过自组织过程能够聚合形成离散的树状分支的纤维丛和具有不同直径的长纤维等高级纤维结构,表现出明显的结构多态性;与微丝工具药物鬼笔环肽干预下自装配形成的主要由单根微丝和微丝束等纤维成份构成的连续网络结构明显不同。
关键词
肌动蛋白;自组织;结构多态性;原子力显微镜
中图分类号: Q245 ;Q-334
文献标识码: A
文章编号: 1007-7146 (2004) 04-0253-05
Preliminary Observation on the Structural Polymorphism of Actin Filaments in Self-organizing in vitro using Laser Atomic Force Microscope
ZHANG Jun1 , 2 , WANG Yuan-liang1 , Chen Xin-yong3 , HE Chuang-long1 , CHENG Chao1
(1. Key Lab of Biomechanics & Tissue Engineering , Ministry of Education , Chongqing University , Chongqing 400044 , China ;
2. Biology Department , Chongqing University of Medicine Sciences , Chongqing 400016 , China : 3. Laboratory of Biophysics and Surface Analysis , University of Nottingham , Nottingham NG7 2RD , United Kingdom)
Abstract
The laser atomic force microscope , a novel tool for surface structure exploration , is employed to investigate the struc-tural polymorphism of actin filaments by self-organization in vitro. It is demonstrated that the actin can be polymerized into tree-like branch structure and long filaments with different diameters in F-buffer without the addition of F-actin stabilizing reagent , such as phalloidin etc. , which is capable of inhibiting the F-actin from depolymerization. These polymerized filaments clearly exhibit the structural polymorphism and show obvious difference from those in the cross-linked network mainly composed of single F-actin and F-actin bundle in the presence of phalloidin under same experimental conditions in previous experiments.
Key words
actin ; self-organization ; structural polymorphism; atomic force microscope
肌动蛋白(Actin) 是真核细胞内最保守、含量最丰富的蛋白质之一,作为细胞骨架和结构的主要成分,具有极其重要的细胞生理功能[1 ,2 ] 。肌动蛋白一般以球形肌动蛋白(G-actin) 和纤维性肌动蛋白( F-actin , 即微丝) 两种形式存在。G-actin 的一级序列通常由375 个氨基酸残基组成,分子量约为43KD ,溶液中,在Mg2 + , K+ , Na + 及ATP 诱导下能自聚合形成高分子量、右手双螺旋结构的F-actin[3 ,4 ] 。在体内,肌动蛋白不仅作为必需成分参与肌球蛋白介导的肌肉收缩[5 ,6 ] ,并可以通过受调控的聚合动力学过程[7 ]或凝胶-溶液转化[8 ] 单独介导细胞运动;而且越来越多的研究表明,肌动蛋白参与了远比以前人们认为的更加广泛和复杂的生命活动,如细胞粘附、信号转导、离子通道调控等等[9~14 ] 。由于肌动蛋白在真核细胞中担负了多种重要的生理功能,是细胞内最重要的蛋白质之一,因而自从被发现以来,其结构和功能研究成为细胞生物学和结构生物学的重要内容。不仅多种晶体形式的G-actin 精细原子结构已获得阐明[15~17 ] ,而且高分辨率的F-actin 原子结构模型也通过纤维X-射线衍射[18 ,19 ] 和电子显微镜成像而得到建立[20~22 ] ;虽然人们在肌动蛋白高分辨率的结构解析研究中获得了巨大成功,但是对肌动蛋白体外大尺度结构体系却关注较少。而肌动蛋白在体内行使正常生理功能时,是依赖于大尺度的超分子结构体系,并非以单个G-actin 或单根F-actin 来发挥其细胞功能。
为了探索肌动蛋白体外大尺度自聚合结构体系,我们利用原子力显微镜———一种已广泛应用于肌动蛋白结构、功能及动力学研究的新型表面结构分析仪器[23 ] ,对肌动蛋白体外自组织纤维结构进行了研究,发现肌动蛋白在没有F-actin 稳定剂(如鬼笔环肽) 存在的情况下,能够通过自组织过程形成离散的、树状分支的纤维丛和具有不同直径的长纤维结构;与Shao Z , 等人实验中,肌动蛋白在鬼笔环肽介入下形成由单根微丝和微丝束构成的大范围连续网络结构明显不同[24 ] 。这暗示,作为微丝工具药物而广泛应用的鬼笔环肽可能对肌动蛋白大尺度结构形态有较大的影响。
1 材料和方法
1.1 材料
G-actin 提取自牛骨骼肌,纯化按照Spudich 和Watt 等人的方法[25 ] 。分离的肌动蛋白达电泳单点纯,储存于4 ℃的G-缓冲液中备用;Na2ATP、DTT 购自Sigma ,Tris-base 、Tris-HCl 购自Promega , 其余试剂均为国产分析纯;CSPM-2000we 型原子力显微镜为中国科学院化学研究所本原纳米仪器有限公司生产,使用NANOPROBETM NP 型Si3N4 探针。
1.2 方法
1.2.1 溶液配制 G-缓冲液( 2mmolPL Tris-Cl ,pH7. 5 , 0. 2mmolPL CaCl2 , 0. 5mmolPL DTT , 0. 2mmolPL ATP) 和F-缓冲液(5mmolPL Tris-Cl , pH7. 5 , 2mmolPLMgCl2 , 100mmolPL KCl , 1mmolPL DTT , 1mmolPLATP) 均按常规方法制备,所有使用的溶剂和新鲜配制的溶液均通过<0. 22μm 的滤膜过滤去除颗粒。
1.2.2 待测样品制备 用F-缓冲液将1ml 纯化G-actin 精确稀释至100ml ,使溶液中G-actin的最终浓度为5μgPml ,然后将样品置于37 ℃恒温箱中孵育30min 使其聚合。聚合完成后,在新鲜剥离的云母表面滴加5μl 待测溶液,使其自然脱水制成待测样品。
1.2.3 原子力显微镜成像 样品制备完成后不经过任何物理和化学处理,立即在室温下(25℃) 用原子力显微镜的接触模式成像。原子力显微镜采集的图像保存为BMP 格式,储存在电脑中做进一步的分析。上述所有操作均在超净工作条件下进行,以避免污染。
2 结果
2.1 树状分支结构的纤维丛
肌动蛋白在体外通过自组织能够聚合形成离散的、具有典型分形结构特征的树状分支纤维丛结构,但不能形成大区域的连续网络结构(Fig. 1) ;与微丝稳定剂鬼笔环肽存在时,形成由单根微丝和微丝束组成的、大范围的连续交联网络结构明显不同[24 ] 。
实验中,肌动蛋白通过自组织形成的树状分支纤维丛由多级纤维分支形成,次级纤维成份间的相互作用和微丝动力学过程的动态平衡可能是树状分支结构产生的必要条件,但详细的聚合动力学机制还有待进一步的研究。
2.2 不同直径的纤维结构
肌动蛋白可通过自组织过程聚合形成不同直径(7nm~35nm) 的长纤维,实验中观察到的最细纤维的结构参数与单根无鬼笔环肽结合时的F-actin[19 ]一致(Fig. 2 a) ;此外,还有大量具有较大直径和分支结构的纤维出现,表明有不同于单根微丝和微丝束的高级纤维结构产生(Fig. 2 b~d) 。但高级纤维结构的构成模式还有待深入研究,初步判断观察到的高级结构可能是由若干单根微丝经过(多级) 螺旋或其它构成方式形成的有序结构。

Fig. 1 Tree-like branch structure with fractal features.
The structure seems to be composed of multiple order helix filaments with branches , which actually indicate the possible mechanism for formation of high order actin filaments by self-organization.

Fig.2 Filaments with different diameters.
(a) The slimmest single filament is most similar to F-actin in size with ~7 nm width at half height and ~35 nmpitch ; (b) the filaments have much wider diameter than the slimmest F-actin ; (c) The branch filament could be con-stituted of two enlaced slimmer filaments , forming the branch in the joining point of another filament ; (d) Two fila-ments are aligned side by side , and thought that there might exist certain interaction between them , which could be theearly step for further assembly of giant filaments. The unit of scale ruler is nm.
2.3 自组织纤维结构的3D-重建
利用计算机3D成像技术对自组织纤维结构进行了3D 构建以获取有用的表面结构细节,结果表明不同类型的纤维结构具有类似的表面构象和拓扑性质,提示各种类型的纤维结构可能来源于相同的聚合动力学过程。
2.3.1 树状分支结构的3D-重建 对树状分支结构的纤维丛局部区域进行了3D-重建,发现其表面存在明显的螺纹结构(Fig. 3) ,表明粗纤维可能由更细的构成成份缠绕螺旋而成;但分支节点的结构还未能清晰地解析,其构成方式需进一步研究。
2.3.2 长纤维结构的3D-重建 从长纤维结构的3D-重建图中,可观察到不同直径的纤维表面存在与树状分支结构表面类似的螺纹结构( Fig. 4) 。虽然长纤维结构和分支结构具有不同的表观形态,但是二者在构成方式、聚合动力学过程以及有序结构多态性形成的分子机制上可能存在本质的联系。

Fig.3 3D-reconstruction of branch structure.The spiral flight can be clearly observed on the fila-ments surface , which demonstrates that the giant fila-ments could come from the thinner filament by intertwist-ing with one another in self-organization dynamics. Theunit of scale ruler is nm.
3 讨论
实验表明,作为微丝工具药物而广泛应用的鬼笔环肽可能对体外肌动蛋白大尺度聚合结构有较大的影响。在体外简单热力学体系中,肌动蛋白自组织为单纯的、无干预的热力学过程,完全受其内在的热力学特性所驱动。利用肌动蛋白聚合动力学的踏车模型可以较好地对肌动蛋白自组织行为进行定性的分析:在F-缓冲液中,肌动蛋白的聚合过程在经过成核期、生长期之后能够迅速进入动态平衡。此时,结合态的纤维型肌动蛋白残基与游离的球型肌动蛋白含量保持动态平衡。微丝的总体长度处于相对恒定的状态,受总长度的限制,单根微丝长度有限,微丝间的相互作用较难发生,形成交联的几率很小,因此在自组织过程中,肌动蛋白难以聚合形成连续的交联网络纤维结构,只能形成离散的纤维结构;在微丝稳定剂(如鬼笔环肽) 介入时,肌动蛋白聚合在经过成核期进入生长期之后,肌动蛋白体外自装配由于微丝解聚合过程被抑制而受到干预,正常的聚合P解聚合动态平衡受到破坏,导致自装配向聚合单方向进行,使溶液中的游离肌动蛋白和寡聚体浓度很低, 此时几乎所有的肌动蛋白均聚合为微丝,微丝的总长度接近最大,单根微丝相对较长,彼此之间的相互作用较易发生,因而容易形成大范围的交联网络结构。
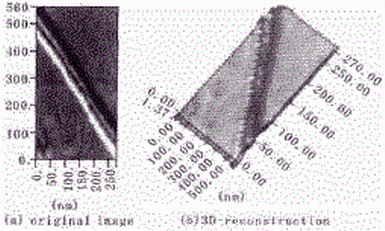
Fig.4 3D-reconstruction of two parallel filaments with different diameters. On the surface of the filaments , similar topological and conformational structure traits can be discerned ;suggesting that all the filaments observed in the experi-ment could result from the same thermodynamic process.The unit of scale ruler is nm.
References
[1]POLLARD T D , COOPER J A. Actin and actin-binding pro-teins. A critical evaluation of mechanisms and functions[J] .Annu Rev Biochem , 1986 , 55 :98721035.
[2]COLUCCIO L M, BRETSCHER A. Reassociation of mi-crovillar core proteins : making a microvillar core in vitro[J] .J Cell Biol , 1989 , 108 :4952502.
[3]ESTES J , SELFEN L , KINOSIAN H , GERSHMAN L.Tightly bound divalent cations of actin[J] . J Muscle Res Cell Motil , 1992 , 13 :2722284.
[4]SHETERLINE P , CLAYTON J , SPARROW J C. Actin in protein profile[M] . New York : Academic Press , 1995.
[5]HOLOLMS K C. A molecular model for muscle contraction [J] . Acta Crystallogr A , 1998 , 54 :789-797. [6] POLLARD T D. Actin[J]. Curr Opin Cell Biol , 1990 , 2 :33-40.
[7]SMITH SJ . Neuronal cytomechanics: the actin-based motilityof growth cones[J] . Science , 1988 , 242 :708-715.
[8]POLLARD T D , AEBI U , COOPER J A , FOELER W E ,TSENG P. Actin structure , polymerization , and gelation[J].Cold Spring Harbor Symp Quant Biol, 1982 , 46 (2) : 513-524.
[9]HELDMAN A W, et al. Cell signalling and motile activity [J]. Symp Soc Exp Biol , 1993 , 47 :317-324.
[10]GAVIN R H. Microtubule-microfilament synergy in the cy-toskeleton[J]. Int Rev Cytol , 1997 , 173 :207-242.
[11]ATENCIA R , ASUMENDI A , et al. Role of cytoskeleton in apoptosis[J]. Vitam Horm , 2000 , 58 :267-297.
[12]TITU M A , GILBERT S P. The diversity of molecular mo-tors : an overview[J ] . Cell Mol Life Sci , 1999 , 56(324) :181-183.
[13]LUO L. Actin cytoskeleton regulation in neuronal morpho-genesis and structural plasticity[J ] . Annu Rev Cell Dev Bi-ol , 2002 , 18 :601-635.
[14]CRITCHLEYD R , HOLTM R , BARRY S T, et al. Inte-grin-mediated cell adhesion : the cytoskeletal connection[J ] .Biochem Soc Symp , 1999 , 65 :79-99.
[15]KABSCH W, MANNHERZ H G, SUCK D , et al. Atomic structure of the actin :DNase I complex[J] . Nature , 1990 ,347 :37-44.
[16]MCLAUGHLIN P J , GOOCH J T, MANNHERZ HG,WEEDS AG. Structure of gelsolin segment 1-actin complex and the mechanism of filament severing[J ] . Nature , 1993 ,364 :685-692.
[17]SCHUTT C E , MYSLIKJ C , ROZYCKI M D ,et al. The structure of crystalline profilin-beta-actin [J] . Nature, 1993 , 365 :810-816.
[18]HOLMES K C , POPP D , GEBHARD W, KABSCH W.Atomic model of the actin filament [J ] . Nature , 1990 , 347 :44-49.
[19]LORENZM. , POPP D , HOLMES K C. Refinement of the F-actin model against x-ray fiber diffraction data by the use of a directed mutation algorithm [ J ] . J Mol Biol , 1993 ,234 :826-836.
[20]BREMER A , MILLONIG R C , SUTTERLIN R , et al. The structural basis for the intrinsic disorder of actin filament :the lateral slipping model [J ] . J Cell Biol , 1991 , 115 :689-703.
[21]BREMER A , HENN C , GOLDIE KN ,et al. Towards atom-ic interpretation of F-actin filament three dimensional recon-structions[J ] . J Mol Biol , 1994 , 242 :683-700.
[22]MILLIGAN R A , WHITTAKER M, SAFER D. Molecular structure of F-actin and location of surface binding sites[J ] .Nature , 1990 , 348 :217-221.
[23]ZHANGJ , WANG YL ,GUL , PANJ . Atomic force micros-copy of actin[J ] . Acta BiochimBiophys Sin , 2003 , 35(6) :489-494.
[24]SHAO Z, SHI D , SOMLYO A V. Cryoatomic force micros-copy of filamentous actin [J ] . Biophys J , 2000 , 78 (2) :950-958.
[25]SPUDICH J A , WATT S. The regulation of rabbit skeletal muscle contraction ⅠBiochemical studies of the interaction of the tropomyosin-troponin complex with actin and the pro-teolytic fragments of myosin[J ] . J Biol Chem , 1971 , 246 (15) : 4866-4871.
作者简介
张军:男,1973 年10 月17 日出生,四川南充人,博士研究生。重庆医科大学任教,从事细胞生物学、生物物理与生物化学领域科研工作。已有7 篇学术论文被SCI , Medline , CA等国际检索系统收录。
Biography
ZHANG Jun : male , born in the 17th of October 1973. He is a Ph D graduate and also teaches in the Chongqing University of Medical Sciences , majoring in cell biology , biochemistry and biophysics. He has published 7 articles that have been cited by SCI , Medline and CA.